2021年3月16日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)周斌研究组在Nature Metabolism期刊上在线发表了的研究成果Pre-existing beta cells but not progenitors contribute to new beta cells in the adult pancreas。该研究开发了能够同时示踪胰岛beta细胞和非beta细胞的双同源重组介导的谱系示踪新技术,利用该技术研究人员揭示了成体胰岛beta细胞的来源,发现在正常稳态及组织损伤情况下成体胰岛beta细胞来源于自我增殖,而非干细胞分化。该研究为糖尿病临床治疗研究提供了重要的理论基础和研究新思路。

周斌研究组长期致力于新型遗传谱系示踪技术的开发与应用,在该项研究中,他们建立了一种可以同时标记胰岛beta细胞和非beta细胞的新型双同源重组介导的谱系示踪新系统(图1a)。基于课题组前期开发的Dre-rox和Cre-loxP的双同源重组酶介导的遗传谱系示踪技术(He et al., Nature Medicine 2017)【15】基础上,研究人员突破以往研究模式,不再依赖单一分子标记追踪某一群细胞分化情况,而是同时且不可逆地区分标记所有beta细胞和其他可能含有潜在干细胞的所有非beta细胞。研究人员使用实验室构建的正交位点特异性双同源重组系统Cre-loxP和Dre-rox的交叉型报告小鼠IR1。在IR1报告小鼠中,两对重组识别位点(rox和loxP)交错排列,这样,一次成功的重组可以诱导表达一种遗传报告基因,并且还阻止了另一次重组的发生。研究人员设计与构建了Ins2-Dre用于标记和占位所有的胰岛beta细胞, beta细胞中的Dre-rox重组首先从IR1中删除了包含一个loxP位点和ZsGreen的rox片段,因此该等位基因随后表达tdTomato并且不再对Cre-loxP重组有反应。同样,使用实验室之前验证过的诱导型Cre系统R26-iCre标记非beta细胞,该系统由R26-rtTA和TRE-Cre等位基因组成(图1b),在该系统中,四环霉素(Dox)介导的rtTA与TRE结合导致Cre表达,非beta细胞中的Cre-loxP重组可去除loxP片段,去除的片段包含一个rox位点和转录终止序列,从而阻止Dre-rox介导的重组,即使该非beta细胞(例如干细胞)分化为产生胰岛素的beta细胞,新产生的beta细胞也将表达ZsGreen而不是tdTomato。该设计可以用两个不同的永久遗传标记同时区分标记beta细胞和非beta细胞:tdTomato和ZsGreen。
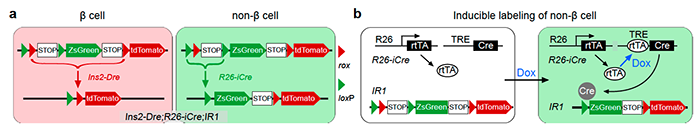
图1
研究人员首先利用该系统研究了在成体胰腺生理稳态过程中beta细胞的来源,在6周龄大的Ins2-Dre;R26-iCre;IR1小鼠上诱导Dox1周,然后在3或6个月后分析胰腺组织(图2a),组织荧光检测可以看到整个胰腺组织标记为ZsGreen,中间夹杂着tdTomato阳性信号(图2b)。通过切片染色发现胰岛 beta细胞仍标记为tdTomato,没有发现ZsGreen阳性的beta细胞(图2c,d),说明在生理稳态条件下,beta细胞主要来自于已有beta细胞的自我复制。
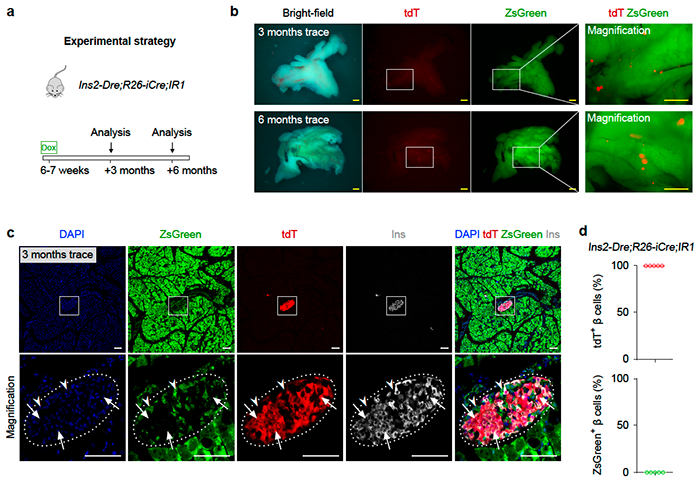
图2
研究人员还构建了胰腺部分切除(partial pancreatectomy, PPX)和妊娠(pregnancy)介导的胰岛beta细胞再生模型、胰腺导管结扎(pancreatic duct ligation, PDL)模型、链脲佐霉素(streptozotocin, STZ)介导的糖尿病模型等,在这些非遗传操作损伤模型中均没有发现ZsGreen阳性的细胞表达Insulin。此外,还构建了新的白喉毒素介导的细胞清除小鼠IR1-DTR,对Ins2-Dre;R26-iCre;IR1-DTR小鼠注射白喉毒素,研究人员发现在清除绝大部分beta细胞(>99%)的情况下,恢复一段时间后可以找到少量ZsGreen阳性的细胞表达Insulin,说明即使非beta细胞贡献少量Insulin阳性细胞,该系统也可以捕捉到的,证明了系统的有效性。
Ins2-Dre作为一种持续性重组酶,可能会意外地标记非常罕见的假定干细胞,这些干细胞可能瞬时表达过Insulin。为了避免这种可能存在的情况,周斌组建立了一种可诱导性饱和示踪的方法(Lineage Tracing at Saturation)。研究人员构建了新的特异性诱导型Ins2-DreER基因敲入小鼠品系和靶向Hipp11(H11)基因座的报告基因工具小鼠H11-rox-tdTomato(图3a)。在成体阶段通过他莫昔芬诱导beta细胞进行遗传标记( tdTomato),那么其他非beta细胞为tdTomato阴性(图3b)。在一段时间之后,如果有tdTomato阴性的非beta贡献产生新的beta细胞,它们将表达Insulin,因为此时已经没有他莫昔芬发挥作用而不会被tdTomato标记上。该策略的精确度很大程度上取决于beta细胞诱导标记效率。如果beta细胞标记的饱和度非常接近100%(比如99.9%),当tdTomato阴性的beta细胞的百分比显著增加(超过0.1%),则可以解释为新的beta细胞产生于干细胞。研究人员在Ins-DreER; H11-rox-tdTomato成年小鼠注射他莫昔芬1周(+1W)之后分析组织样本(图3c),发现该小鼠具有非常高的beta细胞标记效率(图3d),并且这些tdTomato 阳性细胞仅是Insulin 阳性的beta细胞而不是胰岛中其他类型内分泌细胞,证明了该系统的特异性。研究人员利用这个高效且特异的可诱导型beta细胞示踪系统研究了不同生理病理条件下beta细胞来源,再次证实beta细胞主要来源于已有beta细胞的自我复制。
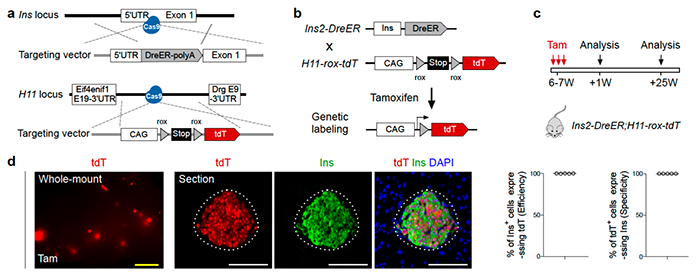
图3
综上,该研究的亮点在于开发了一种双同源重组酶介导的谱系示踪新技术来研究成体胰岛beta细胞来源。突破了传统思维模式和技术局限性,可以不依赖于beta细胞干细胞或祖细胞的特定标记,同时且不可逆地区分标记胰岛beta细胞和非beta细胞,发现不同生理及损伤状态下,成体beta细胞产生主要来源于自我复制,而非干细胞分化(图4)。新构建的一系列遗传工具小鼠可以为胰岛beta细胞及其他组织器官发育、疾病、再生等研究提供了强大的技术支持,该研究成果可以为糖尿病临床治疗提供重要理论基础和新的研究方向。













